Kad dzelzs deficīts slēpj autoimūnu gastrītu
Diāna Lisova, gastroenteroloģe
50 gadus veca sieviete vērsās pie gastroenterologa ar sūdzībām par ilgstošu nogurumu, samazinātu slodzes toleranci.
Laboratorie izmeklējumi uzrādīja mikrocitāru anēmiju (Hgb 92 g/L, MCV 74 fL) un zemu feritīna līmeni (8 ng/ml). Gremošanas trakta asiņošanas izslēgšanai tika veikta augšējā endoskopija un kolonoskopija. Augšējās endoskopijas laikā diagnosticēta kuņģa korpusa gļotādas atrofija. Biopsijas apstiprināja kuņģa korpusa gļotādas atrofiju un metaplāziju ar hronisku iekaisumu. Asins analīzēs konstatētas pozitīvas kuņģa parietālo šūnu antivielas (>100 U/ml) un pozitīvas antivielas pret iekšējo faktoru.
Dg.: autoimūns gastrīts (AIG) ar sekundāru dzelzs deficīta anēmiju.
Secinājumi:
- Apsveriet autoimūnu gastrītu kā iespējamu dzelzs deficīta anēmijas cēloni pieaugušiem pacientiem, īpaši sievietēm postmenopauzes vecumā.
- Veiciet seroloģiskos testus uz parietālo šūnu antivielām un antivielām pret iekšējo faktoru, ja ir aizdomas par AIG.
- Nosūtiet pacientus uz endoskopiju un kuņģa biopsiju, lai apstiprinātu diagnozi un izvērtētu gļotādas atrofijas pakāpi.
- Uzraugiet pacientus ilgtermiņā, jo autoimūns gastrīts palielina kuņģa neoplāzijas risku. Gastroskopijas kontrole jāveic ik pēc 3-5 gadiem.
- Regulāri kontrolējiet feritīna, Hgb un B12 vitamīna līmeni, jo pacientam laika gaitā var attīstīties megaloblastiska anēmija.
- Nepieciešama substitūcijas terapija ar p/o vai i/v dzelzs ievadi, B12 deficīta gadījumā – parenterāli Vit B12.
Šie ieteikumi palīdzēs nodrošināt efektīvu AIG pacientu uzraudzību un ārstēšanu, samazinot komplikāciju risku un uzlabojot dzīves kvalitāti.
Autoimūna gastrīta patofizioloģija, klīniskā aina, diagnostika un ārstēšana
Kristīne Ričarda Muceniece, GASTRO CENTRA medicīnas studente
Autoimūns gastrīts (AIG) ir imūnmediēts hronisks iekaisums kuņģa skābi producējošā gļotādā ar sekojošu kuņģa parietālo šūnu destrukciju.
Tā ir salīdzinoši reti sastopama slimība, un tās prevalance vispārējā populācijā ir no 0,3 % līdz 2,7 %. Sievietes slimo biežāk nekā vīrieši proporcijā 3:1.1
Ir pierādīta saistība starp autoimūnu gastrītu un citām autoimūnām saslimšanām – tādām kā:2
- autoimūns tireodīts – 36 %;
- reimatoīdais artrīts – 9 %;
- SSV – 6 %;
- celiakija – 3 %.
Patofizioloģija
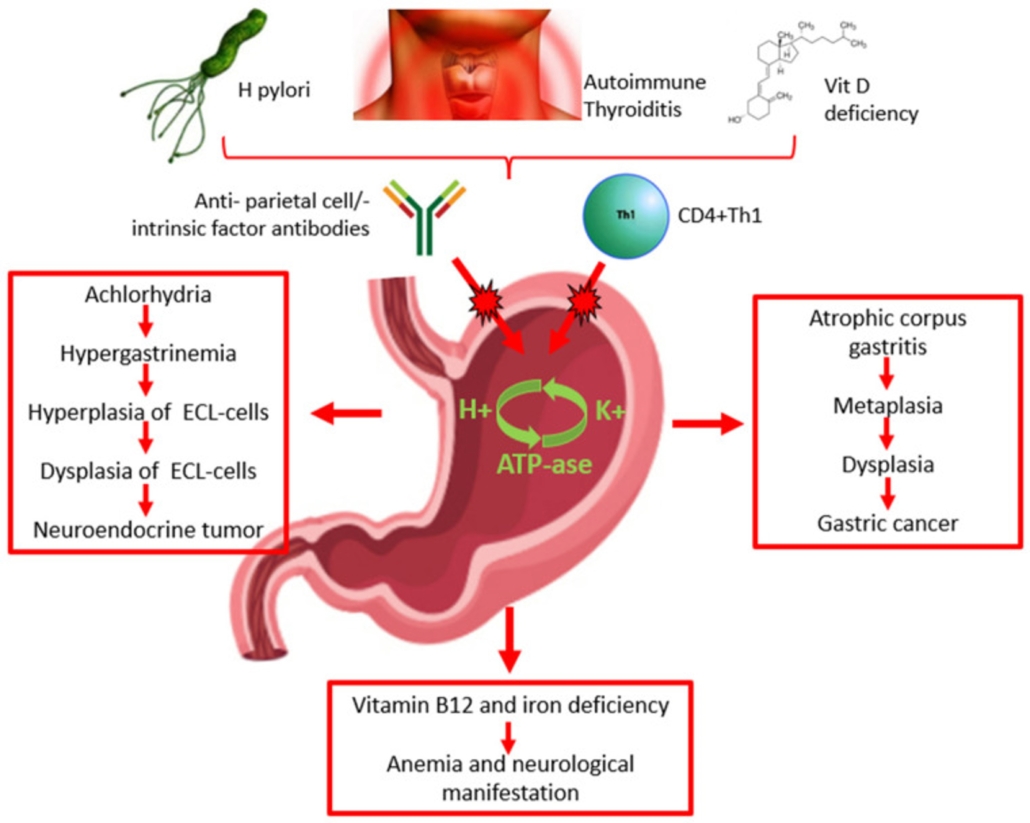
Lai labāk izprastu, kas ir autoimūns gastrīts un kāda ir tā klīniskā aina un diagnostikas principi, nepieciešams noskaidrot, kāds ir šīs slimības rašanās iemesls. AIG patofizioloģijas mehānismu var vienkāršoti aprakstīt sešos posmos:1 3 4
- autoreaktīvu T limfocītu veidošanās un aktivācija pret parietālām šūnām kuņģa gļotādā;
- autoantivielu sintēze pret kuņģa parietālām šūnām (H+/K+ ATPāze) un iekšējo faktoru, ģeneralizēts iekaisums kuņģa korpusā;
- parietālo šūnu bojāeja un rezultējoša hipohlorīdija kuņģī;
- hipohlorīdija kuņģī stimulē G šūnas sekretēt gastrīnu, un attīstās hipergastrinēmija;
- hipergastrinēmija savukārt izraisa enterohromafīno šūnu hiperplāziju;
- iekšējā faktora trūkums neļauj uzsūkties B12 vitamīnam ileum, savukārt augsts pH neļauj Fe3+ reducēt uz Fe2+, kas ir uzsūcamā dzelzs forma.
Vienlaikus gan jānorāda, ka AIG patofizioloģija nav līdz galam izpētīta un izprasta.
1. attēls. Autoimūna gastrīta patofizioloģijas mehānisms.4
Klīniskā aina
Pacienti ar autoimūnu gastrītu var būt asimptomātiski, jo sevišķi sākumā, kad vēl nav attīstījies plašs iekaisums kuņģa gļotādā.
Taču visbiežāk ir novērojama nespecifiska dispepsijas simptomātika (57 % pacientu):1 4
- dedzināšana kuņģī;
- pilnuma sajūta pēc ēšanas;
- nelaba dūša.
Kā jau norādīts iepriekš, iekaisums un parietālo šūnu bojāeja kuņģa korpusa gļotādā rezultējas ar dzelzs un B12 vitamīna uzsūkšanās traucējumiem, kas savukārt noved pie hemopoēzes traucējumiem un gala rezultātā anēmijas ar klasisku simptomātiku kā:1 4
- vājums, nespēks;
- sirds palpitācijas;
- elpas trūkums pie fiziskas slodzes.
Autoimūna gastrīta saistība ar kuņģa vēzi
1. tipa NET
Ir pierādīta korelācija starp autoimūnu gastrītu un kuņģa 1. tipa neiroendokrīnu tumoru (NET). Dažādos pētījumos dati variē, taču vidēji autoimūna gastrīta pacientiem ir 11 reizes lielāks risks kuņģa 1. tipa NET nekā vidēji populācijā.5
Tas rezultējas ar vidējo incidenci 2,2 %. Bet dažos retrospektīvos pētījumos 5 gadu kumulatīvā incidence sasniedz pat 15,3 %.6 7 8 Šādam audzējam ir laba prognoze (5 gadu dzīvildze ir gandrīz 100 %), kaut arī tas bieži recidivē (45 mēnešu periodā 52 % pacientu bija recidīvs).9
Kuņģa adenokarcinoma
Savukārt pētījumu dati par autoimūna gastrīta un kuņģa adenokarcinomas saistību ir pretrunīgi.
Vairākos pētījumos pacientiem ar AIG adenokarcinomas risks bija trīs reizes lielāks nekā vidēji populācijā ar incidenci 0,5 % gadā. Svarīgi norādīt, ka pētījumā iekļautie pacienti visbiežāk bija virs 60 gadu vecuma ar smagu atrofisku autoimūnu gastrītu un B12 deficīta anēmiju.1
Vienlaikus 2023. gada prospektīvā kohortas pētījumā ar 211 autoimūna gastrīta pacientiem 7,5 gadu periodā nevienam pacientam neattīstījās kuņģa adenokarcinoma.10
Diagnostika
Ņemot vērā, ka autoimūns gastrīts ir salīdzinoši reti sastopama saslimšana ar pietiekami nopietnām komplikācijām, ir svarīgi iegaumēt, kad par šo diagnozi būtu jāaizdomājas.
Ja pacientam ir:1 10 15
- neizskaidrojama anēmija;
- dzelzs vai B12 deficīts;
- autoimūns tireodīts;
- refraktāra dispepsija;
- endoskopiski izolēta atrofija kuņģa korpusā,
tad noteikti jāaizdomājas par iespējamu autoimūnu gastrītu.
Diagnostikā ir pielietojami šādi izmeklējumi:
Asins analīzes:1 10 15
- anti-parietālo šūnu antivielas (jutība 81 % / specifitāte 90 %);
- anti-iekšējā faktora antivielas (jutība 27 % / specifitāte ~99 %);
- Gastropanel® ( PG1/PG2, gastrīns 17 un pylori antivielas) (jutība 70,4 % / specifitāte ~98,4 %);
- hromogranīns A nav rekomendēts AIG diagnostikā.
Endoskopija ar biopsijām: “zelta standarts” AIG diagnostikā1 10 15
- Fibrogastroskopija ar 2 biopsijām no antrum un 2 biopsijām no kuņģa korpusa un 1 biopsija no leņķa. Histoloģiski nozīmīgi atšķirt autoimūnu no pylori izraisīta gastrīta (1. tabula).
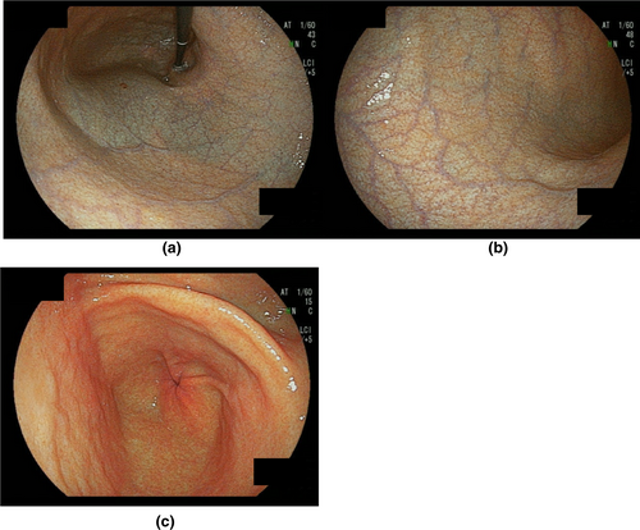
- Vizuāli un histoloģiski raksturīga atrofija tikai kuņģa korpusā (1. attēls), savukārt pylori infekcijas gadījumā antrumā.
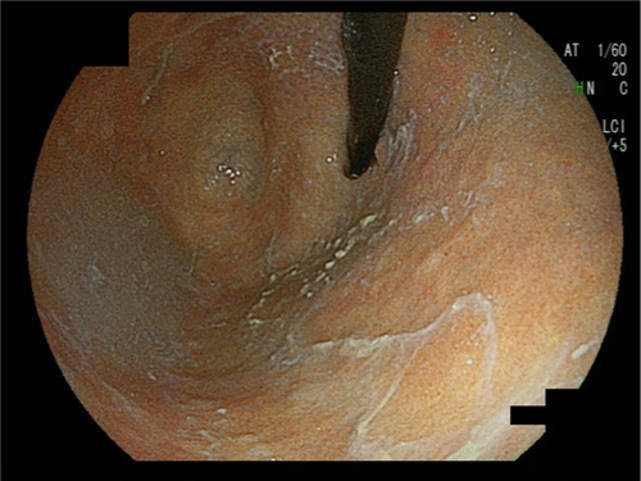
- Vizuāli ureāzes pozitīvu baktēriju izdalītas lipīgas gļotas kuņģa fundus un korpus rajonā (32,4 % AIG pacientu) (71,4 %, ja AIG un kuņģa vēzis) (2. attēls).
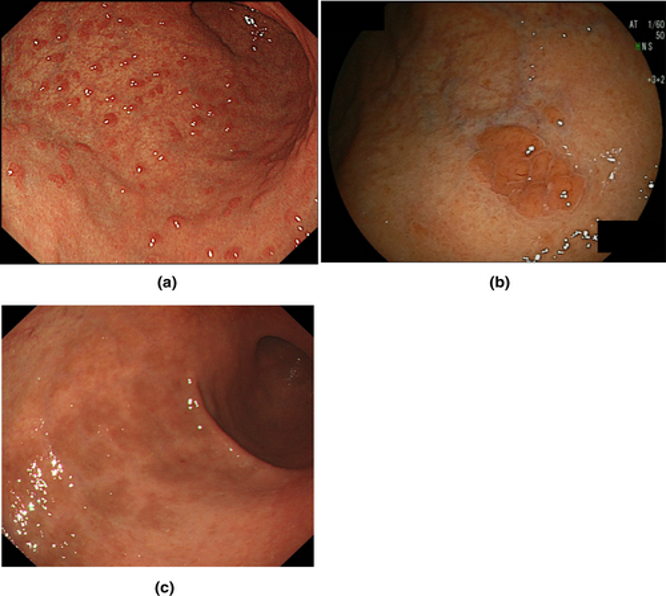
- Reziduālas kuņģa skābi producējošās gļotādas saliņas 31,5 %–45,3 % (3. attēls).
Diagnozei ir jābalstās vienlaicīgi uz pozitīvu seroloģisku un histoloģisku atradni.
2. attēls. Tipiska atrofija autoimūna gastrīta gadījumā.11
3. attēls. Ureāzes pozitīvu baktēriju izdalītas lipīgas gļotas kuņģa fundus un korpus rajonā.11
4. attēls. Kuņģa skābi producējošās gļotādas saliņas.11
| Pazīme | Autoimūns gastrīts | H. pylori gastrīts |
| Iekaisuma infiltrāts | Perēkļains vai difūzs limfocītu infiltrāts, bieži dziļāk gļotādā lamina propria | Tipiski difūzs limfoplazmātisks infiltrāts augšējos gļotādas slāņos, raksturīgi neitrofīlie leikocīti |
| Atrofijas un intestinālas metaplāzijas izplatība | Perēkļaina atrofija un metaplāzija izolēti kuņģa korpusā | Difūza atrofija un metaplāzija, kas raksturīgi atrodas kuņģa antrum, taču bieži arī korpusā |
| Enterohromafīno šūnu hiperplāzija | Raksturīga atradne AIG pacientiem, īpaši ilgstoša iekaisuma gadījumā | Praktiski nav atrodama |
| Mikroorganismi | Negatīva H. pylori atradne | Pozitīva H. pylori atradne |
- tabula. Histopatoloģiskā atradne autoimūnam un H. pylori izraisītam gastrītam.16
Ārstēšana un kontrole
Pašlaik nav specifiskas etioloģiskas terapijas autoimūnam gastrītam. Kaut arī vairāki imūnmodulējoši medikamenti ir pētniecības stadijā, pagaidām neviens nav apstiprināts lietošanai klīniskajā praksē.
Taču autoimūnu gastrītu ir iespējams simptomātiski ārstēt un kontrolēt, lai tas nerada sūdzības un komplikācijas. Kā jau iepriekš norādīts, dispepsija ir viena no galvenajām sūdzībām autoimūna gastrīta pacientiem. Ņemot vērā, ka kuņģa korpusa atrofijas dēļ ir palielināts kuņģa skābes pH, PSI un citi skābi mazinoši medikamenti nav indicēti AIG pacientiem dispepsijas ārstēšanā. Vienlaikus terapijā dispepsijas gadījumā efektīvi var būt gan standarta dzīvesveida ieteikumi, gan arī alginātu un sukralfāta lietošana.1 12
Pacientiem ar autoimūnu gastrītu nepieciešams monitorēt dzelzs un B12 vitamīna līmeni asinīs, kā arī anēmijas attīstību. Regulāri ieteicams veikt pilnu asins ainu (anēmijas diagnostika), feritīnu (dzelzs rezerves), B12 un folskābi (deficīts). Papildus – homocisteīns (B12 un folskābes līmenis ilgtermiņā), TSH (augsts risks autoimūnam tireodītam).1 12
Atbilstoši ESGE vadlīnijām, ņemot vērā paaugstināto ļaundabīga audzēja risku, autoimūna gastrīta pacientiem rekomendējama kontroles fibrogastroskopija ar biopsijām reizi 3 līdz 5 gados.14
H. pylori un autoimūns gastrīts
Saistība starp H. pylori infekciju un autoimūnu gastrītu vēl nav pilnībā izpētīta, taču ir novērots, ka pacientiem ar H. pylori infekciju ir 5 reizes augstāka incidence autoimūnam gastrītam, kā arī pacientiem ar H. pylori infekciju ir augstāks titrs ar anti-parietālo šūnu antivielām, savukārt eradikācijas terapija šo titru samazina.1 10
Pašlaik vadošā teorija ir, ka H. pylori infekcijas gadījumā, notiekot parietālo šūnu bojājumam, attīstās krusteniska reakcija starp H. pylori un parietālo šūnu antigēniem, veicinot autoimūnu reakciju kuņģa gļotādā.1
Ņemot vērā iepriekš norādīto saistību un to, ka H. pylori infekcija ir riska faktors kuņģa vēzim un dzelzs deficīta anēmijai, tad, lai novērstu kumulatīvu efektu starp autoimūnu gastrītu un H. pylori infekciju, gan ESGE, gan AGA vadlīnijas rekomendē visiem pacientiem ar autoimūnu gastrītu H. pylori eradikācijas terapiju.10 14
Endokrinoloģes prof. Dr. med. Ilzes Konrādes komentārs:
“Autoimūnais gastrīts (AIG) ir hroniska slimība, ko raksturo kuņģa parietālo šūnu imūnmediēta destrukcija, kas noved pie aklorhidrijas, hipergrastrinēmijas un B12 vitamīna deficīta. Ilgstoša gastrīna līmeņa paaugstināšanās stimulē enterochromaffin-like (ECL) šūnu proliferāciju, kas laika gaitā var izraisīt I tipa kuņģa neiroendokrīno audzēju (NET) attīstību. Šie audzēji parasti ir labi diferencēti ar zemu metastātisku potenciālu, tomēr prasa regulāru endoskopisku uzraudzību.
AIG bieži sastopams kombinācijā ar citām autoimūnām endokrīnām slimībām. Piemēram, saskaņā ar pētījumu, kurā analizēti pacienti ar autoimūnu vairogdziedzera slimību, 33,3 % gadījumos tika konstatēts arī atrofisks gastrīts, uzsverot nepieciešamību proaktīvi izvērtēt kuņģa funkciju šajā pacientu grupā (Aleksandraki K.I. et al., Clin Endocrinol (2014) 80, 685–690).
Svarīgi atcerēties, ka AIG var traucēt arī levotiroksīna uzsūkšanos – kuņģa skābes trūkuma dēļ samazinās zāļu šķīšana, tāpēc bieži nepieciešamas augstākas devas (par 15-40 %) vai šķidrās/mīksto kapsulu formas, kuras Latvijā jāpasūta īpaši. Un otrādi – visiem pacientiem, kuriem neizdodas sasniegt eitiroīdu stāvokli, neskatoties uz pareizu medikamenta lietošanu tukšā dūšā 30 min. pirms brokastīm, jāizvērtē iespējamā AIG klātbūtne, nosakot specifiskas antivielas.
No imūnmodulācijas viedokļa ieteicams noteikt D vitamīna līmeni un nepieciešamības gadījumā to normalizēt. Lai gan ir interesanti nelieli pētījumi par Omega-3 taukskābju, selēna un glutationa prekursoriem imūnsistēmas līdzsvarošanai, pierādījumu bāze ir nepietiekama.
AIG raksturīgā ilgstošā gastrīna līmeņa paaugstināšanās stimulē enterohromofīno (ECL) šūnu proliferāciju, kas laika gaitā var izraisīt I tipa kuņģa neiroendokrīno audzēju (NET) attīstību. Šie audzēji, bieži multipli, parasti ir labi diferencēti ar zemu metastātisku potenciālu, tomēr prasa regulāru endoskopisku uzraudzību. Ja histoloģiski noteiktais Ki67 1-2 %, šāda atradne neprasa detalizētu onkoloģisku izmeklēšanu. Svarīgi, ka protonu sūkņu inhibitoru lietošana gastrīna līmeni vēl vairāk paaugstina, tādejādi var veicināt ECL šūnu hiperplāziju, tādēļ to lietošana pieļaujama vien stingru indikāciju gadījumos.”
Atsauces:
- Castellana C, Eusebi LH, Dajti E, et al. Autoimmune Atrophic Gastritis: A Clinical Review. Cancers (Basel). 2024;16(7):1310. Published 2024 Mar 28. doi:10.3390/cancers16071310
- Kalkan Ç, Soykan I. Polyautoimmunity in autoimmune gastritis. Eur J Intern Med. 2016;31:79-83. doi:10.1016/j.ejim.2016.03.025
- Hall SN, Appelman HD. Autoimmune Gastritis. Arch Pathol Lab Med. 2019;143(11):1327-1331. doi:10.5858/arpa.2019-0345-RA
- Park JY, Lam-Himlin D, Vemulapalli R. Review of autoimmune metaplastic atrophic gastritis. Gastrointest Endosc. 2013;77(2):284-292. doi:10.1016/j.gie.2012.09.033
- Mahmud N, Stashek K, Katona BW, et al. The incidence of neoplasia in patients with autoimmune metaplastic atrophic gastritis: a renewed call for surveillance. Ann Gastroenterol. 2019;32(1):67-72. doi:10.20524/aog.2018.0325
- Miceli E., Lenti M.V., Gentile A., Gambini G., Petrucci C., Pitotti L., Mengoli C., Di Stefano M., Vanoli A., Luinetti O., et al. Long-term natural history of autoimmune gastritis: Results from a prospective, monocentric series. Am. J. Gastroenterol. 2024 doi: 10.14309/ajg.0000000000002619.
- Rugge M., Bricca L., Guzzinati S., Sacchi D., Pizzi M., Savarino E., Farinati F., Zorzi M., Fassan M., Dei Tos A.P., et al. Autoimmune gastritis: Long-term natural history in naive Helicobacter pylori-negative patients. Gut. 2023;72:30–38. doi: 10.1136/gutjnl-2022-327827.
- Dilaghi E., Dottori L., Pivetta G., Dalla Bella M., Esposito G., Ligato I., Pilozzi E., Annibale B., Lahner E. Incidence and Predictors of Gastric Neoplastic Lesions in Corpus-Restricted Atrophic Gastritis: A Single-Center Cohort Study. Am. J. Gastroenterol. 2023;118:2157–2165. doi: 10.14309/ajg.0000000000002327.
- Sok C, Ajay PS, Tsagkalidis V, Kooby DA, Shah MM. Management of Gastric Neuroendocrine Tumors: A Review. Ann Surg Oncol. 2024;31(3):1509-1518. doi:10.1245/s10434-023-14712-9
- Shah SC, Piazuelo MB, Kuipers EJ, Li D. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 2021;161(4):1325-1332.e7. doi:10.1053/j.gastro.2021.06.078
- Kamada T, Maruyama Y, Monobe Y, Haruma K. Endoscopic features and clinical importance of autoimmune gastritis. Dig Endosc. 2022;34(4):700-713. doi:10.1111/den.14175
- Taylor L, McCaddon A, Wolffenbuttel BHR. Creating a Framework for Treating Autoimmune Gastritis-The Case for Replacing Lost Acid. Nutrients. 2024;16(5):662. Published 2024 Feb 27. doi:10.3390/nu16050662
- Gomez Cifuentes JD, Sparkman J, Graham DY. Management of upper gastrointestinal symptoms in patients with autoimmune gastritis. Curr Opin Gastroenterol. 2022;38(6):600-606. doi:10.1097/MOG.0000000000000878
- Pimentel-Nunes P, Libânio D, Marcos-Pinto R, et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 2019;51(4):365-388. doi:10.1055/a-0859-1883
- Livzan MA, Gaus OV, Mozgovoi SI, Bordin DS. Chronic Autoimmune Gastritis: Modern Diagnostic Principles. Diagnostics. 2021; 11(11):2113. https://doi.org/10.3390/diagnostics11112113
- Torbenson M, Abraham SC, Boitnott J, Yardley JH, Wu TT. Autoimmune gastritis: distinct histological and immunohistochemical findings before complete loss of oxyntic glands. Mod Pathol. 2002;15(2):102-109. doi:10.1038/modpathol.3880499